银屑病IL-23 和 IL-17 生物制剂
银屑病生物制剂发展迅猛,是皮肤疾病生物制剂应用最先进、最广泛的疾病。除了最常见的一些IL-23和IL-17生物制剂外,JAK抑制剂也逐步开发用于治疗银屑病。2021年「Lancet」发表的一篇有关银屑病生物制剂的综述,介绍如下。
表皮棘层增厚、表皮突伸长、颗粒层消失、角化过度、角化不全。真皮乳头毛细血管扩张和增殖。血管生成促进免疫细胞渗透到受影响的皮肤,并确保激活和增殖细胞的供应。
另一种假设是,感染后淋巴结中产生的特定皮肤归巢效应和记忆T细胞会随着时间的推移填充皮肤。这些驻留记忆T细胞中的许多具有经典的T17或T22表型,并有助于皮肤的抗微生物防御机制。当这些细胞对皮肤中出现的抗原产生反应或交叉反应时,特别是具有易感遗传背景的个体(如HLA-C*06),它们可能有利于银屑病的发展。这种激活可以由最小的皮肤创伤触发,这可以促使局部髓系树突状细胞和巨噬细胞分泌IL-23和TNF-α触发,从而增加驻留在皮肤中的记忆T细胞产生IL-17和IL-22。此外,高浓度的脂肪酸(模拟肥胖)有利于骨髓树突状细胞产生IL-23。此外,银屑病皮损中存在自身反应T细胞的抗原。
驻留T细胞在银屑病病变发展中的非常重要。银屑病治疗后,一些致病性T细胞仍保留在原发皮损中。这些驻留细胞能够寡克隆产生IL-17和IL-22,可促进随后的疾病复发,这可能解释了在相同皮肤部位频繁出现病变的原因。从临床角度来看,这些发现非常重要;抑制长期驻留T细胞发育,早期和积极治疗可防止局部复发,理论上可以防止银屑病复发。
注:美国默克于2014年9月与印度太阳药业有限公司达成协议,以总计8000万美元出售旗下银屑癣药物替曲吉珠单抗给后者。
因此IL-23抑制主要用于无脊椎关节炎银屑病患者。此外,希望或需要延长注射间隔时(例如,在患者依从性低的情况下),IL-23抑制也是一个很好的选择。一些患者(例如,有念珠菌感染倾向或有癌症病史的患者),IL-23抑制剂可能比靶向IL-17或TNF的生物制剂更可取。
无法预测类转换后IL-17抑制剂疗效,即一种单抗转换成另一种单抗。尽管一些关于IL-17阻断剂转换的研究报告与未接受治疗的患者相似的疗效,但有些研究观察到转换后的效果减弱。根据临床经验、抗体亲和力、靶向表位和作用模式,最有效的转换可能是从苏金单抗转换为依奇珠单抗或布罗达单抗。
IL-23信号中的JAK激活导致STAT3的磷酸化。该转录因子调节IL-17A、IL-17F、IL-22和IL-23R的表达。此外,STAT3传递IL-6(一种与T17细胞编程密切相关的细胞因子)和IL-22、IL-19、IL-20和IL-24的信号,这些信号直接作用于角质形成细胞。尽管STAT3研究比较透彻,但其被选择性化合物抑制剂仍是一个药学挑战。
此外,靶向IL-17或IL-17受体与炎性肠病的恶化或暴发有关。尽管这些病例很少见,但炎性肠病患者或有风险的患者应避免使用IL-17抑制剂。IL-23抑制剂可导致炎症性肠病的临床缓解,如利散吉珠单抗2期临床研究所示。
IL-17抑制剂中,布罗达单抗治疗最初与临床试验中的自杀事件相关。然而,Lebwohl及其同事整理了来自五项布罗达单抗临床试验的精神病学不良事件数据,并分析了4464名患者和9162名患者年的布罗达单抗暴露,发现布罗达单抗与自杀意念和行为之间因果关系的证据不足。甚至显示布罗达单抗治疗后抑郁症状有所改善。
JAK抑制剂和其他免疫抑制剂一样,可能会增加感染(尤其是水痘-带状疱疹病毒感染)和恶性肿瘤的风险。JAK3和JAK1抑制剂不良事件还有胆固醇升高,而JAK2抑制与贫血风险相关。血栓栓塞事件是一些JAK抑制剂治疗的罕见风险。
简介
银屑病是一种免疫介导慢性炎症性疾病,全球患病率2-3%,男女、年龄发病无差异。20-40岁是发病第一高峰,55-70岁是发病第二高峰。
一般认为银屑病是由遗传易感等位基因和环境因素相互作用引起的多因素疾病。获得性和先天免疫途径均参与银屑病的发病。易感人群可由机械创伤、上呼吸道链球菌感染、压力、晒伤或某些全身药物(如β受体阻击剂、锂、抗疟药)等刺激引发银屑病。这些因素刺激白细胞介素(IL)-23的产生,IL-23诱导几种细胞因子(包括IL-17),这些细胞因子有直接或间接改变角质形成细胞和其他皮肤组织细胞的功能。
银屑病患者通常有许多共病,如代谢综合征(糖尿病、动脉高血压、血脂异常和肥胖)、心血管疾病和抑郁症。1/4多的患者会有银屑病性关节炎,约1%的患者有炎性肠病。
银屑病患者通常有许多共病,如代谢综合征(糖尿病、动脉高血压、血脂异常和肥胖)、心血管疾病和抑郁症。1/4多的患者会有银屑病性关节炎,约1%的患者有炎性肠病。
共病导致发病率和死亡率增加。
临床和组织学特征
银屑病有五种类型:斑块型银屑病、点滴型银屑病、反向型银屑病、脓疱性银屑病(包括掌跖脓疱病、肢端皮炎和泛发性脓疱性银屑病)和红皮病型银屑病。斑块型银屑病占所有病例的90%,其特征是红色斑块表面覆以银色板层鳞屑。可发生任何部位,好发于四肢伸侧、脐周、肛周、耳后和头皮。
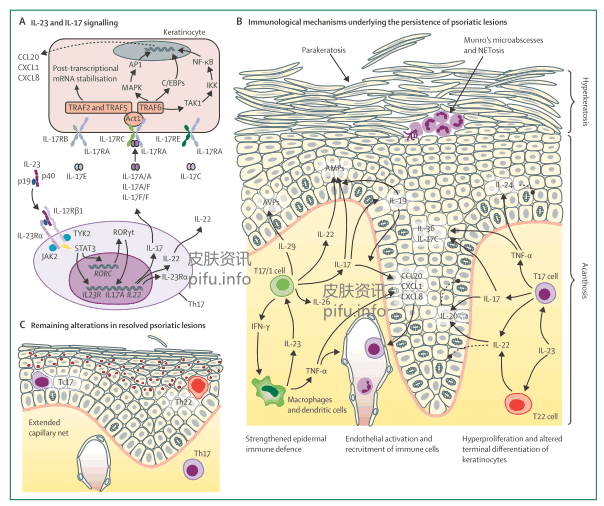
银屑病皮损真皮层巨噬细胞、树突状细胞和T细胞浸润,表皮CD8+T细胞和中性粒细胞浸润。角质层Munro微脓肿形成。浸润的免疫细胞释放的细胞因子,如巨噬细胞和树突状细胞分IL-23,T细胞分泌IL-17。这两个细胞因子是银屑病治疗两个最主要的靶点。
银屑病皮损真皮层巨噬细胞、树突状细胞和T细胞浸润,表皮CD8+T细胞和中性粒细胞浸润。角质层Munro微脓肿形成。浸润的免疫细胞释放的细胞因子,如巨噬细胞和树突状细胞分IL-23,T细胞分泌IL-17。这两个细胞因子是银屑病治疗两个最主要的靶点。
表皮棘层增厚、表皮突伸长、颗粒层消失、角化过度、角化不全。真皮乳头毛细血管扩张和增殖。血管生成促进免疫细胞渗透到受影响的皮肤,并确保激活和增殖细胞的供应。
发病机制
基因
全基因组关联研究(GWAS)确定了80多个银屑病易感位点,并揭示了皮肤型银屑病和银屑病关节炎之间的遗传差异。银屑病主要与HLA-C*06:02相关,这是一种位于PSORS1中的MHC I类分子,因此这也说明了抗原呈递和适应性免疫在银屑病发病中的作用。PSORS1位点可能包含与银屑病易感性相关的其他基因,其功能相关性是当前和未来研究的问题。
GWAS还发现了IL12B、IL23R、TYK2、STAT3和TRAF3IP2与银屑病相关。这些基因编码的分子在IL-23和IL-17信号传导中起着核心作用。因此,GWAS的发现支持IL-23和IL-17信号在银屑病发病机制中起着至关重要的作用。
其他基因强调角质形成细胞在银屑病发病机制中的潜在作用。如PSORS4位点上编码晚期角化包膜蛋白的基因,以及与NF-κB信号通路有关的编码CARD14基因。
与银屑病相关的几种遗传基因,如IL23R、IL12B和TRAF3IP2,也与其他免疫介导疾病(如克罗恩病、脊椎炎和腹腔疾病)的遗传有关,这表明这些免疫介导疾病具有相似的致病机制。
大多数与银屑病相关的基因变异的生物学后果尚不确定。
大多数与银屑病相关的基因变异的生物学后果尚不确定。
鉴于银屑病相关的单核苷酸多态性(SNPs)主要位于非编码区域,如内含子和基因间区域,阐明其功能非常困难。连锁不平衡、等位基因异质性和远程遗传效应增加了复杂性。
现在对一些引起氨基酸取代的非同义snp的功能研究已取得了初步成果。rs11209026是一个位于编码IL-23受体链α (IL-23Rα)的基因中的SNP,在381位谷氨酰胺代替精氨酸,阻止IL-23诱导的T辅助(Th) 17细胞产生IL-17,对银屑病具有保护作用。类似保护性多态性的例子还有抑制IL-12刺激的Th1细胞中STAT3和STAT4磷酸化的TYK2变异。TNFAIP3基因的多态性与银屑病抗肿瘤坏死因子治疗的反应有关,该基因编码锌指蛋白(A20),可负向调节TNF诱导的通路。
IL-23
单克隆抗体特异性抑制IL-23,皮损显著减少,甚至完全消失,这表明IL-23在银屑病皮损的持续中起着关键作用。IL-23是一种异二聚体蛋白,由二硫键连接的p19和p40亚基组成。p40编码基因IL12B中的一个SNP与银屑病有关。银屑病皮损中IL-23的表达明显升高。皮肤CD11c+免疫细胞,如巨噬细胞和不同亚群的髓样树突状细胞,是银屑病病变中IL-23的主要细胞来源。因此,单核细胞、巨噬细胞和髓样树突状细胞似乎是银屑病发病的关键细胞。
分泌的IL-23通过由两种跨膜蛋白组成的细胞受体复合物介导其作用:IL-12Rβ1和IL-23R。细胞外结构域与IL-23结合,而其细胞内结构域与Janus激酶(JAK)TYK2和JAK2结合。这些酪氨酸激酶将磷酸基团转移到细胞内信号分子的酪氨酸残基,从而将细胞因子结合信号从细胞外传播到细胞内部。
分泌的IL-23通过由两种跨膜蛋白组成的细胞受体复合物介导其作用:IL-12Rβ1和IL-23R。细胞外结构域与IL-23结合,而其细胞内结构域与Janus激酶(JAK)TYK2和JAK2结合。这些酪氨酸激酶将磷酸基团转移到细胞内信号分子的酪氨酸残基,从而将细胞因子结合信号从细胞外传播到细胞内部。
IL23R和TYK2的变异与银屑病相关。IL-23Rα胞内结构域内酪氨酸残基的磷酸化可使STAT3和STAT4转录因子结合和磷酸化,这些转录因子以同源二聚体形式迁移到细胞核中,调节多个基因的表达。磷酸化STAT3增强了另一种转录因子,即RORγt的基因表达。STAT3和RORγt与IL17A、IL17F、IL22、IL26和IL23R等基因的启动子结合,诱导其表达。
IL-23在银屑病病变中最重要的作用可能是稳定Th17细胞的分泌细胞因子的状态,以及促进效应和记忆T细胞产生IL-17。
IL-23在银屑病病变中最重要的作用可能是稳定Th17细胞的分泌细胞因子的状态,以及促进效应和记忆T细胞产生IL-17。
Th17细胞还可以分泌IL-22、IL-26和IL-29,银屑病皮损中这些细胞因子浓度升高。因此,使用特异性抑制IL-23的单克隆抗体治疗银屑病可能会直接减少银屑病相关淋巴细胞细胞因子(如IL-17)的产生,并从长远来看,减少皮肤中致病性T细胞的数量。
银屑病皮损中的IL-17主要由CD4 +和CD8+T细胞产生,如Th17和细胞毒性T细胞(Tc)17(T17细胞)。此外,IL-17也可由ILC3和被称为T17/1细胞的T细胞群产生,同时具有T17和T1(Th1和Tc1)细胞的特征。
与IL-23相似,IL-17家族细胞因子通过受体复合物作用于其靶细胞,受体复合物由两个跨膜蛋白组成。IL-17RA和IL-17RC的跨膜复合物不仅传递IL-17(如IL-17A同源物),也传递IL-17A-IL-17F异源物和IL-17F同源物的作用。IL-17RA链也是IL-17C(与IL-17RE相互作用时)和IL-17E(与IL-17RB相互作用时)的受体信号复合物的一部分。
IL-17
IL-17是由IL-17A分子组成的同源二聚体。 有几个蛋白质在结构上与IL-17A相似,如IL-17B、IL-17C、IL-17D、IL-17E(也称为IL-25)和IL-17F,这些分子共同构成了IL-17家族。 IL-17A还能与IL-17F以二硫键连接的异构体结合。IL-17A是迄今为止被研究得最清楚的IL-17家族细胞因子。银屑病皮损中的IL-17主要由CD4 +和CD8+T细胞产生,如Th17和细胞毒性T细胞(Tc)17(T17细胞)。此外,IL-17也可由ILC3和被称为T17/1细胞的T细胞群产生,同时具有T17和T1(Th1和Tc1)细胞的特征。
与IL-23相似,IL-17家族细胞因子通过受体复合物作用于其靶细胞,受体复合物由两个跨膜蛋白组成。IL-17RA和IL-17RC的跨膜复合物不仅传递IL-17(如IL-17A同源物),也传递IL-17A-IL-17F异源物和IL-17F同源物的作用。IL-17RA链也是IL-17C(与IL-17RE相互作用时)和IL-17E(与IL-17RB相互作用时)的受体信号复合物的一部分。
IL-17信号转导
IL-17A同源二聚体、IL-17A-IL-17F异源二聚体或IL-17F同源二聚体与IL-17RA-IL-17RC复合物的结合导致Act1(细胞内中心信号元件)与受体结合。Act1编码基因TRAF3IP2的SNP与银屑病发病风险有关。Act1似乎是IL-17家族信号的唯一来源。一旦招募Act1,IL-17RA-IL-17RC-Act1复合物会迅速招募其他信号分子,如TRAF6、TRAF2和TRAF5。TRAF6促进IκB激酶(IKK)的激活和磷酸化IκB的次序蛋白体降解,导致NF-κB的释放和核转位,并增加NF-κB靶基因的转录,如编码IkBζ的基因。
TRAF2和TRAF5并不促进基因转录,而是激活RNA结合蛋白,反过来增加几种mRNA的稳定性。IL-17本身只有少数和适度的影响,但它与其他银屑病相关的细胞因子如TNF-α、IL-22和IFN-γ有强烈的协同作用。
因此,降低IL-17浓度(通过IL-23中和),或抑制IL-17作用(通过阻断IL-17或IL-17R),是减少银屑病炎症的重要治疗选择。
靶细胞对IL-17的反应
角质细胞是IL-17的皮肤主要靶细胞,另外也可作用于其他皮肤细胞,如成纤维细胞。IL-17诱导角质细胞产生趋化因子(如CXCL1、CXCL8),招募中性粒细胞、 CCL20、T17细胞、T22细胞和骨髓类树突状细胞。
IL-17诱导产生三组细胞因子,每组有特定的作用。
- 第一组IL-36和IL-17C等细胞因子,它们加强组织炎症。
- 第二组细胞因子由IL-17与TNF-α或IL-22联合诱导,如IL-20,可直接引起银屑病样表皮改变。
- 第三组IL-19,它通过正反馈调节扩大IL-17的作用。
银屑病其他相关细胞因子
IL-23和IL-17的产生受到其他细胞因子的调节。例如,IL-4抑制T17细胞IL-17的产生和树突状细胞中IL-23的产生。因此,IL-4在早期临床研究报道可改善银屑病。
除IL-23外,单细胞、巨噬细胞和髓系树突状细胞产生TNF-α,TNF-α是一种多效和强促炎性细胞因子,可诱导产生多种趋化因子,激活内皮细胞,促进免疫细胞向皮肤的渗透。TNF-α还可激活T细胞,增强IL-17对组织细胞的作用,诱导角质形成细胞产生细胞因子,如IL-24,从而直接促进银屑病样表皮改变。这一机制了解释抑制TNF-α可引起屑病明显改善。
除了IL-17,激活的T17和T17/1细胞产生IL-22、IL-26和IL-29,这些都与银屑病病变有关。
除了IL-17,激活的T17和T17/1细胞产生IL-22、IL-26和IL-29,这些都与银屑病病变有关。
IL-22通过IL-22R1起作用,IL-22R1是一种跨膜受体,在特定组织细胞表达,如角质形成细胞,免疫细胞不表达。IL-22增加抗微生物蛋白的产生,抑制角质形成细胞的终末分化,直接导致表皮典型的银屑病样外观。
IL-24(由TNF-α诱导)和IL-20(由IL-17诱导)也通过IL-22R1发挥作用,IL-24和IL-20对角质形成细胞的作用可能代表银屑病发病级联的最终阶段(图1B)。然而,由于这三种细胞因子(IL-22、IL-24、IL-20)具有重叠的功能,仅对抑制一种细胞因子可能不足以产生临床效果。这一假设得到了研究的支持,即抗IL-22单克隆抗体在银屑病患者中因缺乏疗效,已经停止临床试验。IL-26与血管增生相关,血管丧生是银屑病变的一个重要特征。银屑病皮损的另一个特点是表皮抗病毒蛋白的大量表达,这保护受损的银屑病皮肤免受病毒感染。抗病毒蛋白的表达受IL-29调节,IL-29是银屑病皮损中T17细胞释放的细胞因子。使用JAK抑制剂时,一个显著的不良事件是水痘带状疱疹病毒的再激活,JAK抑制剂会破坏IL-29和其他细胞因子的信号传导。
银屑病发病机制尚未回答的问题
目前银屑病发病机制的某些方面尚未完全清楚。现有解释银屑病的机制都是假设。一种假设是,由于创伤较小,受损的角质形成细胞会释放自身DNA或自身RNA,与LL37形成复合物并刺激浆细胞样树突状细胞。活化的浆细胞样树突状细胞分泌IFN-α,通过刺激髓样树突状细胞,增强T17细胞的发育。尽管这种级联事件可能发生在银屑病模型,但似乎与大多数银屑病患者的病变发展或其持续性无关。
事实上,持续性病变中少见浆细胞样树突状细胞。 IFN-α实际上抑制效应T17细胞的发育。此外,效应和记忆T细胞通常来源于淋巴结中的幼稚T细胞,而不是局部组织。此外,I型干扰素往往具有抗增殖作用,但这种作用与这些患者表皮的过度增殖性质相矛盾。1期临床试验发现抗IFN-α未改善银屑病。
另一种假设是,感染后淋巴结中产生的特定皮肤归巢效应和记忆T细胞会随着时间的推移填充皮肤。这些驻留记忆T细胞中的许多具有经典的T17或T22表型,并有助于皮肤的抗微生物防御机制。当这些细胞对皮肤中出现的抗原产生反应或交叉反应时,特别是具有易感遗传背景的个体(如HLA-C*06),它们可能有利于银屑病的发展。这种激活可以由最小的皮肤创伤触发,这可以促使局部髓系树突状细胞和巨噬细胞分泌IL-23和TNF-α触发,从而增加驻留在皮肤中的记忆T细胞产生IL-17和IL-22。此外,高浓度的脂肪酸(模拟肥胖)有利于骨髓树突状细胞产生IL-23。此外,银屑病皮损中存在自身反应T细胞的抗原。
驻留T细胞在银屑病病变发展中的非常重要。银屑病治疗后,一些致病性T细胞仍保留在原发皮损中。这些驻留细胞能够寡克隆产生IL-17和IL-22,可促进随后的疾病复发,这可能解释了在相同皮肤部位频繁出现病变的原因。从临床角度来看,这些发现非常重要;抑制长期驻留T细胞发育,早期和积极治疗可防止局部复发,理论上可以防止银屑病复发。
IL-23和IL-17抑制治疗
治疗方案概述
银屑病有多种治疗方法。治疗选择主要取决于皮肤改变的严重程度(PASI和皮肤病学生活质量量表[DLGI])。轻度疾病(PASI≤10) 以及轻中度生活质量限制(DLQI≤10)银屑病局部治疗即可。最常用的是局部使用皮质类固醇、维生素D或两者的组合。局部使用的二苯丙醇也非常有效,但会刺激皮肤并使大多数接触部位变色,限制了其使用。敏感区域的银屑病可以用局部钙调磷酸酶抑制剂治疗。
中度或重度疾病(PASI>10银屑病)或DLQI>10,需要光疗、常规全身免疫抑制药物、小分子药物或生物制剂。治疗的选择通常因个体因素、伴随疾病、国家指南和批准标准(可能会考虑经济方面)而异。
用于银屑病治疗的化学合成全身免疫抑制药物有环孢素、甲氨蝶呤和阿维A,以及创新小分子如阿普米司特片(Apremilast)和富马酸二甲酯(Dimethyl fumarate)。富马酸二甲酯通过抑制髓系树突状细胞中IL-12和IL-23,阻滞Th1和Th17介导的免疫应答。
生物制剂专门针对促进银屑病或其受体的细胞因子。生物制剂比传统的全身免疫抑制药物或现代小分子药物更有效,因此可被视为中重度银屑病、生活质量严重降低或银屑病关节炎患者的一线治疗药物。然而,许多国家只有在传统的全身免疫抑制药物疗效不足或已被禁用的情况下,才可以使用生物制剂。
中度或重度疾病(PASI>10银屑病)或DLQI>10,需要光疗、常规全身免疫抑制药物、小分子药物或生物制剂。治疗的选择通常因个体因素、伴随疾病、国家指南和批准标准(可能会考虑经济方面)而异。
用于银屑病治疗的化学合成全身免疫抑制药物有环孢素、甲氨蝶呤和阿维A,以及创新小分子如阿普米司特片(Apremilast)和富马酸二甲酯(Dimethyl fumarate)。富马酸二甲酯通过抑制髓系树突状细胞中IL-12和IL-23,阻滞Th1和Th17介导的免疫应答。
生物制剂专门针对促进银屑病或其受体的细胞因子。生物制剂比传统的全身免疫抑制药物或现代小分子药物更有效,因此可被视为中重度银屑病、生活质量严重降低或银屑病关节炎患者的一线治疗药物。然而,许多国家只有在传统的全身免疫抑制药物疗效不足或已被禁用的情况下,才可以使用生物制剂。
批准用于银屑病的11种生物制剂中,特定患者治疗的选择取决于多种因素,如皮肤严重程度和局部情况、银屑病关节炎或脊椎关节炎、个体风险因素、合并疾病、患者年龄、患者的偏好和先前的治疗以及患者的依从性等。通过使用生物制剂,大部分银屑病患者的PASI评分(PASI-90)在短时间内至少降低90%,这一结果支持将PASI-75替换为PASI-90,作为治疗成功的新治疗目标。
绝对PASI为2或更低,或清零或几乎清零,是PASI-90的替代合格治疗目标。
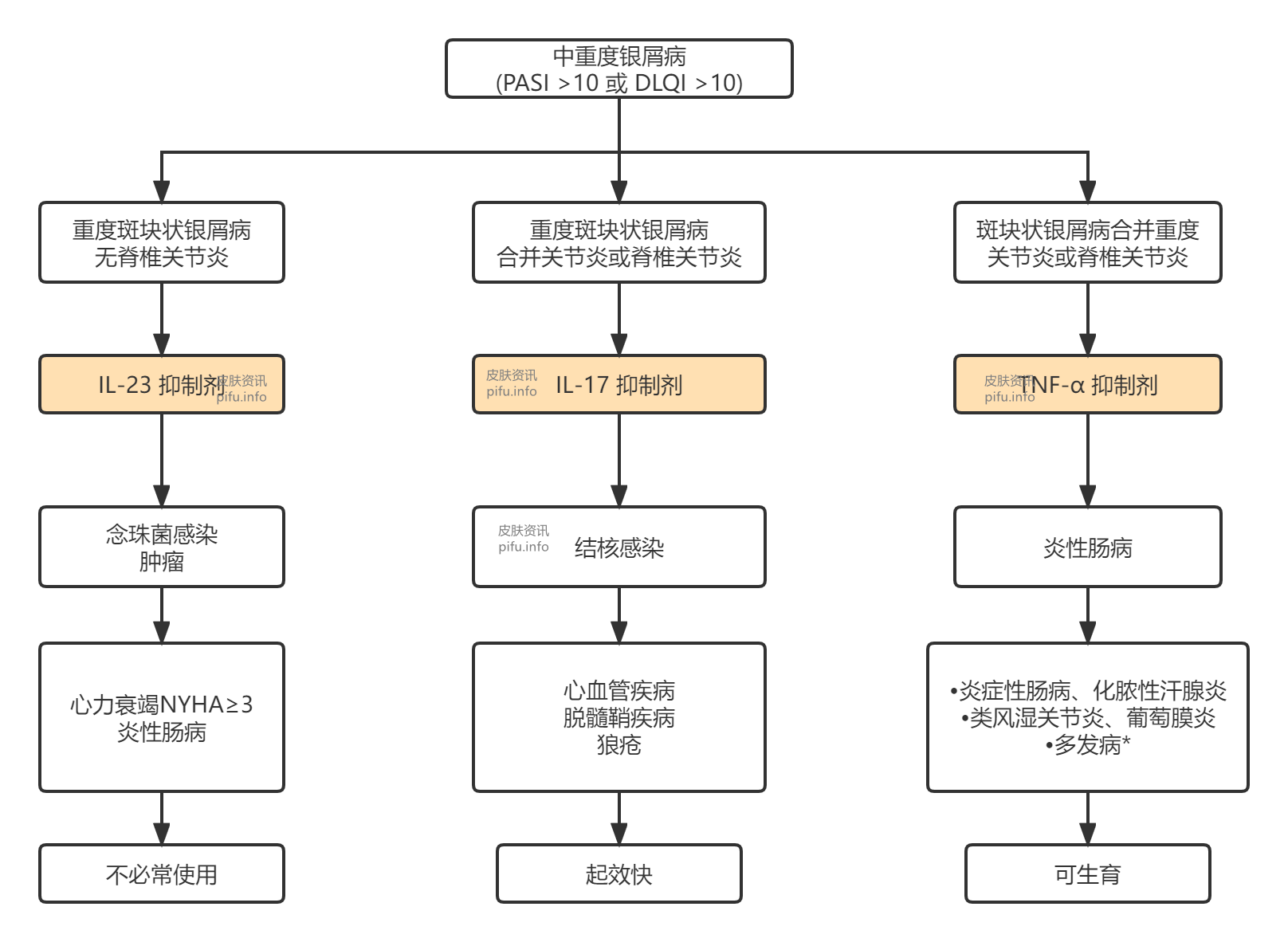
第一组生物制剂是TNF-α抑制剂。获批用于银屑病的抗TNF-α药物有单克隆抗体(英夫利昔单抗和阿达木单抗)、TNF-α的PEG化(聚乙二醇化,polyethylene glycolated)Fab片段单克隆抗体(培塞利珠单抗,Certolizumab Pegol,中文商品名:希敏佳)和天然存在的可溶性人75千道尔顿TNF受体与IgG1(依那西普)Fc部分的融合蛋白。TNF抑制剂用于治疗活动性银屑病关节炎或脊椎关节炎,而非重度银屑病。炎性肠病、有生育意愿的患者和多种疾病患者(首选半衰期短的药物)也可能受益于特定的TNF抑制剂(图2)。
绝对PASI为2或更低,或清零或几乎清零,是PASI-90的替代合格治疗目标。
第一组生物制剂是TNF-α抑制剂。获批用于银屑病的抗TNF-α药物有单克隆抗体(英夫利昔单抗和阿达木单抗)、TNF-α的PEG化(聚乙二醇化,polyethylene glycolated)Fab片段单克隆抗体(培塞利珠单抗,Certolizumab Pegol,中文商品名:希敏佳)和天然存在的可溶性人75千道尔顿TNF受体与IgG1(依那西普)Fc部分的融合蛋白。TNF抑制剂用于治疗活动性银屑病关节炎或脊椎关节炎,而非重度银屑病。炎性肠病、有生育意愿的患者和多种疾病患者(首选半衰期短的药物)也可能受益于特定的TNF抑制剂(图2)。
 |
| 图2. 银屑病生物制剂选择标准 |
IL-23 抑制剂
美国食品和药物管理局(FDA)批准的第一种治疗银屑病的IL-23抑制剂是乌司奴单抗(Ustekinumab),可结合p40亚基的单克隆抗体。由于p40单位由IL-23(由p40和p19组成)和IL-12(由p40和p35组成)共享,乌司奴单抗同时可抑制IL-23和IL-12,因此不是特异性IL-23抑制剂。2017年7月,FDA批准了第一种特异性IL-23抑制剂古塞奇尤单抗(Guselkumab),用于治疗中重度银屑病。古塞奇尤单抗选择性地结合IL-23的p19亚基,并阻止细胞因子结合其细胞膜交叉受体,从而阻止随后的细胞内受体介导的信号传导。
另外两种特异性IL-23抑制剂已经获得批准:替曲吉珠单抗(Tildrakizumab)(2018年)和利散吉珠单抗(Risankizumab)(2019年)。
编码利散吉珠单抗Fc区的DNA序列含有两个突变(Leu234Ala和Leu235Ala),降低了抗体依赖性细胞介导的细胞毒性。Mirikizumab(米吉珠单抗)是一种与IL-23的p19亚基相结合的单克隆抗体,2期临床试验显示75%的中重度斑块型银屑病患者在第16周达到PASI-75,67%的患者达到PASI-90。米吉珠单抗治疗银屑病的3期试验正在进行(NCT03482011、NCT03535194和NCT03556202)。
替曲吉珠单抗似乎比其他特定IL-23抑制剂效果欠佳,这可以通过其对p19的亲和力较低来解释。替曲吉珠单抗的解离常数(Kd)为297 pM,而古塞奇尤单抗的Kd为3.3 pM。
古塞奇尤单抗和散吉珠单抗的临床应答率优于TNF抑制剂。散吉珠单抗疗效似乎优于古塞奇尤单抗。16周利散吉珠单抗与乌司奴单抗的头对头试验,利散吉珠单抗治疗组比乌司奴单抗治疗组多30%的患者达到PASI-90。
对乌司奴单抗反应不佳的患者仍可改用特异性IL-23抑制剂。IL-23抑制剂利散吉珠单抗和古塞奇尤单抗优于乌司奴单抗,表明IL-12在银屑病中具有保护作用。事实上,IL-12诱导分泌IFN-γ的T1细胞的产生,IFN-γ是T17细胞发育的负调节因子。此外,临床前数据表明IL-12减弱角质形成细胞的炎症反应。
中和IL-23的也可改善银屑病关节炎。与这一效果相一致的是,目前替曲吉珠单抗和利散吉珠单抗正在拓展银屑病关节炎适应症,2020年,古塞奇尤单抗获得了FDA和欧洲药品管理局(EMA)的批准用于治疗银屑病关节炎。令人惊讶的是,IL-23的抑制对脊椎炎无效。
注:美国默克于2014年9月与印度太阳药业有限公司达成协议,以总计8000万美元出售旗下银屑癣药物替曲吉珠单抗给后者。
因此IL-23抑制主要用于无脊椎关节炎银屑病患者。此外,希望或需要延长注射间隔时(例如,在患者依从性低的情况下),IL-23抑制也是一个很好的选择。一些患者(例如,有念珠菌感染倾向或有癌症病史的患者),IL-23抑制剂可能比靶向IL-17或TNF的生物制剂更可取。
IL-17 抑制剂
截至2020年12月,四种IL-17抑制剂获批用于银屑病治疗。司库奇尤单抗(Secukinumab)和依奇珠单抗(Ixekizumab)是与IL-17A结合,阻止IL-17A同二聚体和IL-17A–IL-17F异二聚体与其受体相互作用。
布罗达单抗(Brodalumab)是抗IL-17RA单克隆抗体。
由于IL-17RA链参与至少三种不同的受体复合物(图1),布罗达鲁单抗不仅阻止IL-17A同二聚体和IL-17A–IL-17F异二聚体,而且阻止IL-17F同二聚物、IL-17C和IL-17E(IL-25)。与IL-17A一样,IL-17C和IL-17E似乎都会引起皮肤炎症。
IL-17抑制剂的有效性和安全性已在临床试验和现实生活中得到验证。比美吉珠单抗(Bimekizumab)也是IL-17抑制剂。这种单克隆抗体不仅中和IL-17A同二聚体和IL-17A–IL-17F异二聚体,还中和IL-17F同二聚物,后者也具有银屑病相关作用。比美吉珠单抗2期临床试验,93%的患者在12周时达到PASI-75,79%的患者达到PASI-90。比美吉珠单抗的3期试验正在进行(NCT03370133、NCT03410992、NCT0341 2747、NCT03536884)。
无法预测类转换后IL-17抑制剂疗效,即一种单抗转换成另一种单抗。尽管一些关于IL-17阻断剂转换的研究报告与未接受治疗的患者相似的疗效,但有些研究观察到转换后的效果减弱。根据临床经验、抗体亲和力、靶向表位和作用模式,最有效的转换可能是从苏金单抗转换为依奇珠单抗或布罗达单抗。
注意,炎性肠病患者禁用IL-17抑制剂,以避免这种疾病的发作或恶化。
IL-17抑制剂在预防心血管事件中的作用仍有争议。荷兰研究人员报告,与非生物治疗相比,抗TNF和抗IL-17治疗可降低冠状动脉非钙化斑块风险。然而,这项研究样本量较小,需要进一步的证据来证实这些发现。
临床对照试验显示,IL-17的抑制可明显减轻银屑病关节炎和脊椎关节炎的症状。因此苏金单抗和依奇珠单抗现已被FDA和EMA批准用于治疗银屑病关节炎。
IL-17抑制剂应是中重订银屑病和银屑病关节炎或脊柱关节炎患者的首选。
IL-17抑制剂应是中重订银屑病和银屑病关节炎或脊柱关节炎患者的首选。
IL-23和IL-17通路的细胞内靶点
直接靶向IL-23或IL-17的生物制剂的另一种方法可能是干扰细胞内起作用的信号蛋白的小分子。如前所述,跨膜IL-23R复合物与两种酪氨酸激酶JAK2和TYK2有关,这两种激酶对于将IL-23信号传递到细胞中至关重要。然而,JAK2或TYK2对于其他细胞因子的信号转导也至关重要;因此,抑制JAK的治疗是抗多细胞因子效果,无IL-23和IL-17信号通路的特异性治疗。
通过JAK2或TYK2起作用的细胞因子有促进T17细胞生成的介质(如IL-6)和在银屑病中起致病作用的靶向角质形成细胞的介质(IL-22、IL-19、IL-20)。然而,JAK2或TYK2也参与可能对银屑病具有保护作用的细胞因子信号传导,如IL-10和IL-13信号传导。
第一代JAK抑制剂对JAK ATP结合袋具有高度选择性,但其在不同JAK家族成员中的选择性远低于预期。用于银屑病治疗的泛JAK抑制剂的开发并未超出早期试验,因为其毒性和与生物制剂相比的疗效低。因此开发了比第一代更具选择性的第二代JAK抑制剂。
针对银屑病测试的众多JAK抑制剂候选物中,有几个对JAK具有高选择性:
- 巴瑞替尼(Baricitinib)对JAK1和JAK2具有高选择性;
- JAK1和JAK3抑制剂托法替尼(Tofacitinib)(FDA于2017年批准用于银屑病关节炎,EMA于2018年批准);
- JAK1抑制剂的依他替尼(Itacitinib)(INCB039110)和索西替尼(Solcitinib)(GSK2586184)
- JAK1和TYK2抑制剂PF-06700841
- TYK2抑制剂PF-06826647和去氘可来昔替尼(Deucravacitinib)(BMS-986165)
银屑病关节炎的治疗,两种JAK1抑制剂正在临床开发中:菲尔替尼(Filgotinib),第2阶段试验结果已公布;乌帕替尼(Upadacitinib),正在进行的第3阶段试验中进行评估。
IL-23信号中的JAK激活导致STAT3的磷酸化。该转录因子调节IL-17A、IL-17F、IL-22和IL-23R的表达。此外,STAT3传递IL-6(一种与T17细胞编程密切相关的细胞因子)和IL-22、IL-19、IL-20和IL-24的信号,这些信号直接作用于角质形成细胞。尽管STAT3研究比较透彻,但其被选择性化合物抑制剂仍是一个药学挑战。
在这种情况下,一个可行的靶点是RORγt,这是一种共同负责t细胞中IL-17表达的关键转录因子。已开发用于临床的几种RORγt抑制剂中,VTP-43742、BI 730357、JTE-451和AUR101已进入第2阶段开发。关于系统使用所选RORγt抑制剂的初步经验报告令人鼓舞。
与IL-17A受体相关的关键衔接蛋白是Act1,迄今为止,不存在Act1的直接抑制剂。
IL-23和IL-17抑制剂风险和不良事件
药物安全登记处,如英国皮肤科医生协会生物和免疫调节剂登记处(British Association of Dermatologists Biologics and Immunomodulators Register)、银屑病纵向评估和登记处(Psoriasis Longitudinal Assessment and Registry)以及丹麦生物干预登记处(Danish Biologic Interventions Registry),对于监测现实世界中银屑病治疗的安全性和有效性至关重要。从注册数据到现实生活中的经验,IL-23和IL-17抑制剂在真实世界具有令人信服的安全性。与小鼠遗传学研究的结果相反,使用IL-23和IL-17抑制剂治疗的患者没有重大感染风险。
临床试验数据表明,与其他生物制剂相比,IL-23抑制剂的短期安全性略高。然而,需要长期观察和日常实践的研究来证实。
IL-23和IL-17抑制剂的最常见副作用,包括鼻咽炎、上呼吸道感染、注射部位反应和头痛。此外,IL-23和IL-17抑制剂可诱导中性粒细胞减少症(1级和2级)。IL-17抑制剂与非严重念珠菌感染有关。这种风险是因为IL-17对于上皮细胞对包括酵母在内的细胞外病原体的免疫至关重要,抑制IL-17后对念珠菌免疫力降低。
与FIXTURE 3期研究的结果一致,诱导期(12周)发生感染患者比例,300 mg剂量的司库奇尤单抗为26.7%,150 mg剂量的司库奇尤单抗为30.9%,安慰剂为19.3%。52周时,300mg 司库奇尤单抗组4.7%,150mg 司库奇尤单抗组2.3%的患者出现念珠菌感染。依奇珠单抗3期试验中,144名患者在治疗12周期间出现全身感染,特别是念珠菌感染的合并比例为26.9%(一般感染),每2周服用依奇珠单抗的患者为1.4%(念珠菌);每4周服用依奇珠单抗的患者分别为27.5%(一般感染)和0.6%(念珠菌);安慰剂组分别为22.8%(一般感染)和0.5%(念珠菌)。布罗达单抗(AMAGINE-I)3期试验诱导期(12周),140mg剂量组的0.5%、210mg剂量组2.3%,安慰剂组 1.4% 出现念珠菌感染。所有念珠菌感染均为轻度或中度,无全身感染。
此外,靶向IL-17或IL-17受体与炎性肠病的恶化或暴发有关。尽管这些病例很少见,但炎性肠病患者或有风险的患者应避免使用IL-17抑制剂。IL-23抑制剂可导致炎症性肠病的临床缓解,如利散吉珠单抗2期临床研究所示。
IL-17抑制剂中,布罗达单抗治疗最初与临床试验中的自杀事件相关。然而,Lebwohl及其同事整理了来自五项布罗达单抗临床试验的精神病学不良事件数据,并分析了4464名患者和9162名患者年的布罗达单抗暴露,发现布罗达单抗与自杀意念和行为之间因果关系的证据不足。甚至显示布罗达单抗治疗后抑郁症状有所改善。
JAK抑制剂和其他免疫抑制剂一样,可能会增加感染(尤其是水痘-带状疱疹病毒感染)和恶性肿瘤的风险。JAK3和JAK1抑制剂不良事件还有胆固醇升高,而JAK2抑制与贫血风险相关。血栓栓塞事件是一些JAK抑制剂治疗的罕见风险。
结论
分子和细胞研究的进展使银屑病这种慢性炎症性皮肤病归类为IL-23和IL-17主导的疾病。IL-23或IL-17的阻断治疗可显著改善银屑病,甚至消失,并改善大多数银屑病患者的生活质量。
基于其有效性和安全性,针对IL-23和IL-17途径的生物制剂是过去十年皮肤病学的最大成就之一。
未来几年,必须确定哪种疗法能有效地对抗银屑病合并症,特别是代谢、内分泌和心血管疾病。恰当的治疗可提高患者的预期寿命。
另一项主要任务是阐明抗IL-23或抗IL-17疗法对疾病自然病程的影响。早期使用特定疗法不仅可以根除短寿命的致病细胞,而且可以防止长寿命致病细胞的出现。这些细胞的缺失可能是银屑病可能治愈的关键一步。
最后,银屑病IL-23和IL-17抑制剂成功治疗银屑病可为其他慢性炎症疾病的管理和治疗开辟了可能性。
相关文章
Ghoreschi K, Balato A, Enerbäck C, Sabat R. Therapeutics targeting the IL-23 and IL-17 pathway in psoriasis. Lancet. 2021 Feb 20;397(10275):754-766. doi: 10.1016/S0140-6736(21)00184-7 Epub 2021 Jan 27. PMID: 33515492
评论
发表评论
欢迎交流指正